Basic HTML Version

Inżynier i Fizyk Medyczny 2/2012 vol. 1
radiologia
/
radiology
artykuł naukowy
/
scientific paper
41
w porównaniu do emiterów pojedynczych fotonów stosowanych
w klasycznych badaniach radioizotopowych – muszą spełniać szereg
dodatkowych wymagań. Przede wszystkim, aby wydajność scyntyla-
cji była lepsza, ich gęstość musi być odpowiednio duża. Pierwszym
detektorem, który zastąpił uprzednio stosowane rozwiązanie wyko-
rzystujące kryształy NaI, był detektor oparty na kryształach bizmutu.
Obecnie stosuje się kryształy: bizmutu – BGO (
bismuth germinale
),
lutetu – LSO (
cerium-doped lutetium oxyorthosilicate
) oraz gadolinu –
GSO (
cerium-doped gadolinium silicate
). Każdy ze stosowanych krysz-
tałów charakteryzuje się określonymi zaletami. Wydajność rejestra-
cji promieniowania dla 25 mm kryształu LSO lub BGO sięga nawet
80%. Stopień pochłaniania promieniowania dla kryształów BGO jest
większy niż dla LSO, natomiast impuls świetlny w wyniku scyntylacji
w krysztale LSO jest pięciokrotnie silniejszy. Innym istotnymparame-
trem jest czas trwania scyntylacji: dla LSO wynosi on tylko 40 ns, dla
BGO – 300 ns. Należy zaznaczyć, że parametr ten decyduje o czasie
martwymdetektora, a więc o czasie pomiaru promieniowania. Krysz-
tałyGSOmająnieznaczniemniejszągęstośćniżBGO i LSO.Natomiast
pozwalają na detekcję szerokiego spektrum promieniowania: od 28-
35 keV dla 125 I, do 511 keV dla 18 F. GSO emituje nieznacznie silniej-
sze światło niż BGO, a czas trwania scyntylacji wynosi 50 ns.
Każdy moduł detekcyjny składa się z kryształu z odpowiedni-
mi nacięciami wypełnionymi nie przepuszczającym światła ma-
teriałem oraz z czterech fotopowielaczy. Kryształ przeważnie
podzielony jest na 8×8 kwadratów. Na cały pierścień detekcyjny
składa się 200-300 takich modułów. Ideę konstrukcji modułowej
układu detekcyjnego wprowadzono w latach 80-tych (Casey
i Nutt). Dzięki niej można było zastąpić inne rozwiązanie: kon-
strukcję aparatu składającego się z małych kryształów, z których
każdy musiałby być połączony z fotopowielaczem. W koncep-
cji tej każdy fragment kryształu (oddzielony nacięciami) działa
w praktyce jak niezależny system detekcyjny, dzięki czemu wy-
dajność układu jest znacznie lepsza (czas martwy dla systemu
blokowego jest znacznie krótszy niż dla pojedynczego kryształu).
Każdy z modułów detekcyjnych wykrywa interakcję pojedyn-
czego kwantu gamma o energii 511 keV ze scyntylatorem krysta-
licznym. Do zlokalizowania punktu anihilacji potrzebne jest jed-
noczasowe wykrycie dwóch kwantów o energii 511 keV każdy.
W ten sposób dwa punkty pierścienia detekcyjnego wyznaczają
prostą, na której doszło do anihilacji. Stwierdzenie jednoczaso-
wości jest realizowane poprzez zastosowanie tzw. detekcji koin-
cydencyjnej, wykorzystującej okno czasowe o szerokości 5-12 ns.
Czynniki ograniczające
rozdzielczość obrazowania
Wspomniane wcześniej zjawisko „rozmycia” obrazu źródła, wyni-
kające z kształtu widma energetycznego wiązki pozytonów, za-
leży zarówno od ich energii, jak i od gęstości tkanek. W efekcie
powoduje ono pogorszenie rozdzielczości obrazu.
Kolejnym czynnikiem ograniczającym rozdzielczość obrazowania
jest budowa modułu detekcyjnego. Szerokość pojedynczego sekto-
ra kryształu jest znacznie mniejsza niż jego długość. Jest to korzyst-
ne z punktu widzenia sprawności detekcji (dłuższa droga kwantu na
długości kryształu – większe prawdopodobieństwo interakcji). Jed-
nocześnie jednak wzrasta niepewność lokalizacji punktu interakcji
w krysztale, gdyż sam proces interakcji jest losowy. Współczesne
technologie umożliwiają bardzo skuteczną izolację
optyczną pomiędzy sektorami kryształu. Mimo tego
niektóre fotony światła mogą przeniknąć przez war-
stwę izolującą. W efekcie błyski świetlne są wykrywa-
ne w sektorach sąsiadujących z tym, w którym doszło
do interakcji z kwantemgamma o energii 511 keV (tzw.
efekt rozmycia błysku świetlnego –
blurring
).
Inną przyczyną pogarszającą rozdzielczość obrazowa-
nia jest fakt, żewynikający z prawa zachowania pędu kąt
180°, jaki powinny tworzyć kierunki biegu obu kwantów
gamma pochodzących z jednej anihilacji, wykazuje odchylenie rzędu
0.5°. Tak więc, zakładana (w celu rekonstrukcji 3-D) linia prosta obrazu-
jąca drogę przebiegu kwantów (linia łącząca dwa pobudzone detekto-
ry–LOR) nie jest idealna (
anihilationangleblurring
).Wielkość tegobłędu
zależy oczywiście od odległości między dwoma detektorami: jest więc
różna dla kolejnych par detektorów. Przy średnicy wewnętrznej pier-
ścieniadetekcyjnegook. 1mbłądtensięga2-3mm. Zjawisko
toniewystępujewklasycznychbadaniachSPECT.
Detekcjawoknieczasowym,któregoszerokośćmawpływ
na obrazowanie. Jego maksymalna szerokość jest ograniczona przez
prędkość propagacji kwantów gamma w tkankach badanego ustroju.
W czasie 3 ns światło w próżni pokonuje drogę 1 m. Jest to wymiar
średnicy wewnętrznej pierścienia detekcyjnego. Jeśli zatem anihilacja
miała miejsce na obwodzie pola widzenia, to różnica czasów biegu po-
wstałych kwantówgamma wynosi ok. 3 ns. Teoretycznie jest to górna
granica szerokości okna czasowego. Ze względu na losowość przemia-
ny jądrowej (emisja pozytonu przez jądro) i dopuszczalne napromienie-
niepacjenta, stosujesięoknaczasoweoszerokościwiększej, rzędu5-12
ns. Zbyt szerokieokno czasowe – korzystne z punktuwidzeniaochrony
radiologicznej –powoduje, żeukładdecyzyjny uznaje za jednoczasowe
kwantygammapochodzące z różnychpunktówanihilacji.
Źródłem fałszywych informacji jest rejestracja w tym samym
oknie czasowym fotonów pochodzących z różnych zjawisk. Zdefi-
niowano cztery typy koincydencji: prawdziwe, wynikające z promie-
niowania rozproszenia, przypadkowe oraz wielokrotne (multiple).
Tylko w przypadku koincydencji prawdziwych system kom-
puterowy tworzy prawdziwą linię LOR, która przebiega przez
punkt anihilacji: fotony nie podlegają innym interakcjom i trafia-
ją do obu detektorów w oknie czasowym.
Koincydencje rozproszenia występują wówczas, gdy przynajmniej
jeden z fotonów uległ przynajmniej jednemu zjawisku Comptona, na-
tomiast dotarł do detektora w oknie czasowym. Wwyniku tego linia
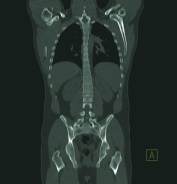
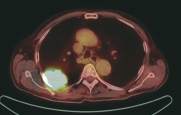
Rys. 3
Chłoniak, stan po chemioterapii – brak remisji choroby
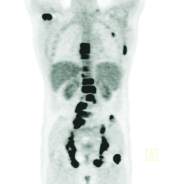
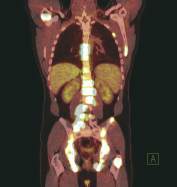
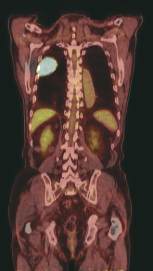
Rys. 4
Diagnostyka wznowy choroby nowotworowej – wznowa raka płuc

