vol. 4 1/2015 Inżynier i Fizyk Medyczny
30
radioterapia
\
radiotherapy
artykuł naukowy
\
scientific paper
w ochronie tkanek prawidłowych znajdujących się w bliskim
sąsiedztwie obszaru tarczowego, ale również zwiększa ryzyko
niedopromienienia miejsca zmienionego nowotworowo w przy-
padku popełnienia nawet niewielkiego błędu geograficznego.
Dlatego też bardzo ważnym elementem w planowaniu i reali-
zacji leczenia staje się problem odpowiedniej stabilizacji pacjen-
ta, która w znacznym stopniu wpływa na jakość realizowanego
leczenia.
Istotą stabilizacji jest utrzymanie ułożenia pacjenta na stole
terapeutycznym w ten sam sposób, w jaki został ułożony na sto-
le tomografu komputerowego – przed rozpoczęciem leczenia.
Obrazy z tomografu komputerowego stanowią obraz statycz-
ny pacjenta, na którym planowana jest geometria planu – licz-
ba wiązek, kształty pól terapeutycznych, rozkład przestrzen-
ny dawki. Dlatego też, aby geometria planu była realizowana
w sposób jak najbardziej odtwarzalny do zaplanowanej, pacjent
musi znajdować się w takim samym położeniu jak podczas plano-
wania leczenia na tomografie. Nawet niewielki błąd w ułożeniu
pacjenta (ruchomość pacjenta) może spowodować przeniesie-
nie wysokiej dawki terapeutycznej z obszaru zainteresowania
na obszar tkanek prawidłowych (Rys. 1).
O degradacji PCL decydują grupy estrowe, które sprawiają,
że polimer ulega rozpadowi w środowisku wodnym poprzez hy-
drolizę wiązań estrowych (dając nietoksyczne i rozpuszczalne
produkty rozpadu) [11], natomiast grupy metylenowe
decydują
o hydrofobowym charakterze polimeru [12].
PCL używany w teleradioterapii ma postać termoplastycz-
nych arkuszy [13]. Przygotowanie materiału do użycia wymaga
poddania go obróbce cieplnej, którą przeprowadza się w kąpie-
li wodnej w temperaturze 65-70°C. Większość materiałów do
tego rodzaju aplikacji posiada perforowaną powierzchnię, co
skraca czas oczekiwania na uplastycznienie. Po wyjęciu mate-
riału z nagrzewarki hydrofobowy charakter poli(
e
-
kaprolaktonu)
umożliwia łatwe i szybkie usunięcie nadmiaru wody, dzięki cze-
mu materiał może być nałożony niemalże bezpośrednio na skórę
pacjenta, bez narażenia go na uczucie dyskomfortu.
Dodatkową zaletą PCL-u są jego szczególne właściwości me-
chaniczne – bardzo dobra elastyczność, wytrzymałość na rozcią-
ganie czy wytrzymałość na udarność – co w połączeniu z jego
stosunkowo niską temperaturą topnienia pozwala na łatwe
i precyzyjne modelowanie materiału do szczegółów anatomicz-
nych pacjenta.
Producenci stabilizatorów nie zastrzegają jednorazowego
użycia maski termoplastycznej, dzięki czemu możliwe jest jego
powtórne zastosowanie. Należy jednak pamiętać o degradacji
polikaprolaktonu, chociażby poprzez wspomnianą hydrolizę
wiązań estrowych, co przy wielokrotnym użyciu prowadzi do
osłabienia jego właściwości mechanicznych. W praktyce klinicz-
nej wielokrotne użycie materiału jest niewskazane ze względów
zapewnienia odpowiednich warunków aseptycznych.
Kolejną cechą charakterystyczną PCL-u jest jego gęstość zbli-
żona do gęstości wody. Wodę przyjmuje się jako ekwiwalent
tkanki miękkiej podczas pomiarów dozymetrycznych, co wska-
zuje na możliwość osłabienia dawki promieniowania po przejściu
przez stabilizator pozycji pacjenta. Jednak w przypadku tego
rodzaju aplikacji, gdzie materiał posiada perforowaną strukturę
o średniej grubości ok. 2 mm, wpływ na osłabienie promienio-
wania waha się między 0,4-0,7% dla energii fotonów 6 MeV [13].
Poprzez oddziaływanie promieniowania jonizującego z cia-
łem pacjenta, na drodze wiązki zaczyna kumulować się pewna,
w zależności od rodzaju i energii promieniowania, dawka po-
chłonięta. Natura oddziaływania promieniowania fotonowego
i elektronów opisywana jest krzywą jonizacji, z której wynika, że
dawka deponowana przez cząstki pośrednio jonizujące rośnie
wraz z głębokością medium do osiągnięcia maksimum, a następ-
nie powoli spada. Bazując na pomiarach krzywych jonizacji i wy-
znaczanych z nich krzywych dawki, planowane są przestrzenne
rozkłady dawki wokół zmiany nowotworowej. Problem zaczyna
pojawiać się wówczas, gdy objętości tarczowe znajdują się w ob-
szarze narastania dawki – obszarze
buildup
(Rys. 3).
Ponieważ w radioterapii wodę przyjmuje się jako ekwiwalent
tkanki miękkiej, zjawisko
buildup
można przenieść na materiał
polimerowy odpowiadający gęstością wodzie – kompensując
w ten sposób żywą tkankę (Rys. 4).
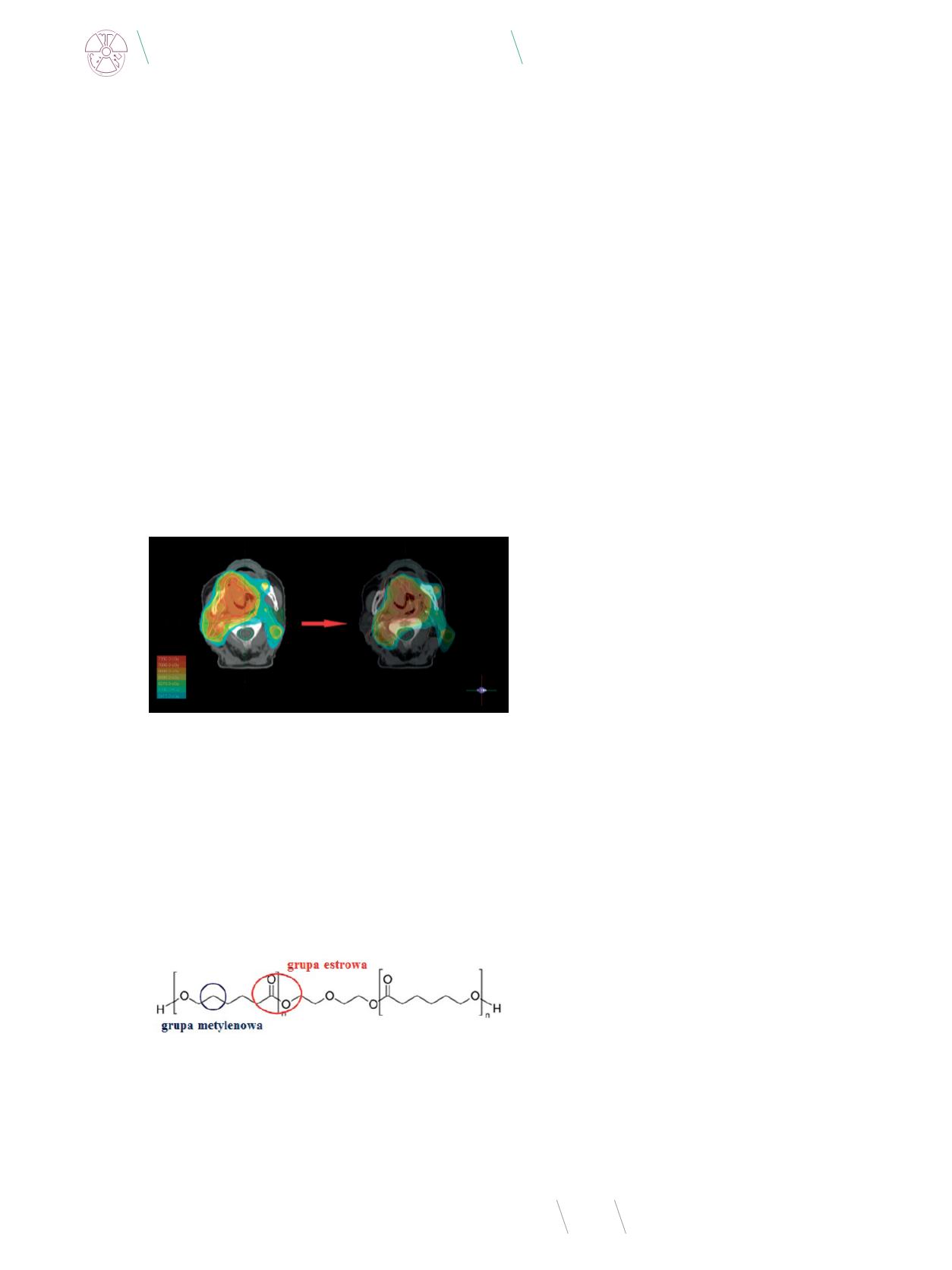
Rys. 1
. Symulacja przeniesienia wysokiej dawki terapeutycznej z obszarów zmienio-
nych nowotworowo na obszar tkanek prawidłowych przy przemieszczeniu się pa-
cjenta na stole aparatu terapeutycznego
Najlepszą stabilizację zapewnia materiał o odpowiednich wła-
ściwościach fizyko-chemicznych i mechanicznych oraz którego
czas krystalizacji jest na tyle długi, aby można było go precyzyj-
ne uformować na ciele pacjenta, uniemożliwiając wykonywanie
ruchów ciała.
Stabilizowanie pozycji pacjenta uzyskuje się poprzez nałoże-
nie na ciało termoplastycznej powłoki, wykorzystującej najczę-
ściej syntetyczny polimer – poli(e-kaprolakton) (Rys. 2).
Rys. 2
. Struktura poli(e-kaprolaktonu)
Poli(
e
-
kaprolakton) (PCL) jest biodegradowalnym, semikry-
stalicznym poliestrem o dość niskiej temperaturze topnienia
(59-64°C) i temperaturze zeszklenia (od -60°C). Jego czas bio-
degradacji określa się na 2 lata, choć sam proces można przy-
śpieszyć poprzez syntezę kopolimerów z udziałem fragmentów
laktydowych lub glikolidowych [9-10].


