dr inż. Ewa Grudzińska
Future Processing, Gliwice, e-mail: egrudzinska@future-processing.com
Za początek rozwoju metod obrazowania przyjmuje się 1895 r., kiedy to Wilhelm Conrad Roentgen odkrył promieniowanie X i wykonał zdjęcia dłoni swojej żony. Od tego czasu następuje nieustanny rozwój obrazowana medycznego. Rozwijane są nowe metody, poprawie ulegają także parametry aparatury medycznej, które powodują, że możemy oglądać obrazy o coraz wyższej jakości. Dzięki temu uzyskujemy większą ilość danych o dużej wartości diagnostycznej. Ale czy poprawa parametrów sprzętu to jedyna droga rozwoju technologicznego obrazowania medycznego?
Diagnostyka obrazowa czy czynnościowa
Diagnostyka chorób sercowo-naczyniowych odbywa się obecnie na podstawie badań obrazowych lub badań czynnościowych, jednak ani jedne, ani drugie nie dają pełnej informacji o organie, który jest najważniejszą częścią układu krążenia. We współpracy ze specjalistami ze Śląskiego Centrum Chorób Serca w Zabrzu eksperci z Future Processing, z dziedziny fizyki i uczenia maszynowego, na podstawie danych obrazowych, starają się uzyskać informacje o funkcjonowaniu serca. Dokładniej mówiąc, analizują oni, jak kształtują się przepływy we wnętrzu naczyń wieńcowych. Aby osiągnąć ten cel, konieczne jest przeprowadzenie procesu obejmującego zaawansowane przetwarzanie danych obrazowych oraz specjalistycznych algorytmów fizyki obliczeniowej.
Uczenie maszynowe w tworzeniu trójwymiarowych modeli naczyń wieńcowych
W procesie przetwarzania danych punkt wyjścia stanowią obrazy angio-TK, na których niejednokrotnie widoczne są artefakty wynikające z nieregularnej pracy serca – tzw. slaby. Slaby, nieciągłość naczyń spowodowana występowaniem blaszek miażdżycowych, mała różnica poziomów szarości to podstawowe problemy, z którymi mierzymy się podczas tworzenia algorytmów do automatycznej segmentacji.
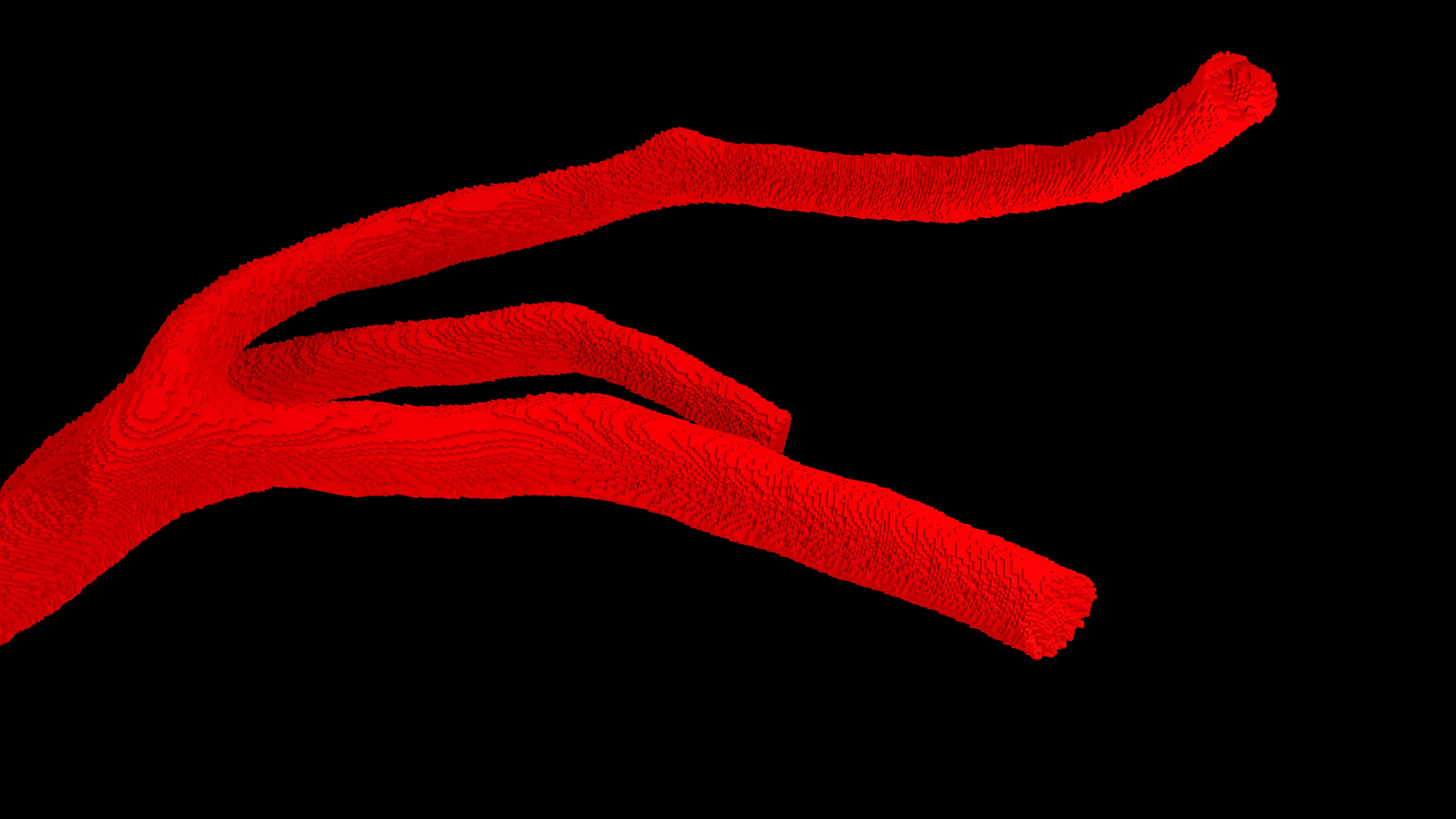
W celu rozwiązania tych problemów i uzyskania optymalnego efektu specjaliści z Future Processing zaprojektowali wielowarstwową, konwolucyjną sieć neuronową. W tej sieci dane będące wynikiem operacji jednej warstwy stanowią dane wejściowe do warstwy następnej. Połączenie wielu warstw pozwala na ekstrakcję bardziej skomplikowanych cech z obrazów medycznych. Dodatkową zaletą stosowania sieci konwolucyjnych jest fakt, że sieć samodzielnie wybiera cechy obrazu (deskryptory), które uważa za najistotniejsze. W efekcie stworzone algorytmy sztucznej inteligencji do automatycznej segmentacji naczyń wieńcowych są odpowiedzią na rozwiązanie problemów występujących podczas zastosowania metod konwencjonalnych. Kolejnym wyzwaniem jest stosunkowo niska rozdzielczość obrazów medycznych, która bezpośrednio wpływa na jakość rekonstrukcji naczyń. Dla danych obecnie pozyskiwanych w pracowniach diagnostycznych krawędź woksela wynosi około 0,5 mm. Przeprowadzona na danych o takiej rozdzielczości trójwymiarowa rekonstrukcja segmentacji daje jedynie przybliżone – za pomocą prostopadłościanów – odwzorowanie trójwymiarowej geometrii tętnicy. Przy standardowej rekonstrukcji tracona jest „gładkość” naczynia (Rys. 1), co staje się problemem, zwłaszcza w przypadku małych naczyń. Klasyczne algorytmy, stosowane do wygładzania trójwymiarowych obiektów, polegają na operacjach, które mogą wpływać m.in. na zmianę objętości obiektu. Aby tego uniknąć, zastosowano metody uczenia maszynowego wyspecjalizowane do operacji na naczyniach krwionośnych. Zaaplikowana metoda pozwala na uczenie sieci tworzenia gładszych modeli (o zwiększonej rozdzielczości) bez zmiany ich objętości.
Rys. 1 Trójwymiarowa rekonstrukcja tętnicy: A. Rozdzielczość oryginalna, B. Wynik zastosowania sieci neuronowej
Wirtualna analiza przepływu
Bazując na stworzonych trójwymiarowych modelach naczyń wieńcowych, można wykonywać symulacje analizy przepływu, pozwalające na obliczenie parametrów przepływowych łatwych w interpretacji klinicznej (naprężenia ścinające, indeksy oscylacyjne, czasy zalegania, etc.). W efekcie bez konieczności wykonywania inwazyjnych badań, możliwa jest ocena istotności zmian miażdżycowych oraz prognozowanie dalszego rozwoju choroby. Obliczenia potrzebne do analizy przepływów wykonywane są metodą Lattice’a Boltzmanna (LBM). Dzięki przeprowadzonym analizom numerycznym możliwa jest wizualizacja parametrów przepływu cieczy w naczyniach. Metoda ta została starannie zweryfikowana poprzez porównanie wyników obliczeń z pomiarami wykonanymi za pomocą innych technik. Jednym z krytycznych
testów tej metody była rekonstrukcja prawidłowej częstotliwości oscylacji w niestabilności von Karmana. Zastosowanie metody LBM i autorskie rozwiązanie pozwalające na ulokowanie obliczeń na układach GPU (Graphics Processing Unit) pozwala na znaczne skrócenie czasu symulacji CFD (Computed Fluid Dynamics) przy zachowaniu dokładności obliczeń. Przy parametrach obecnie dostępnych kart obliczeniowych końcowe wyniki symulacji uzyskiwane są w zaledwie kilkanaście minut, czyli kilkudziesięciokrotnie szybciej niż konkurencyjne rozwiązania.
Wirtualna symulacja – rzeczywista wskazówka diagnostyczna
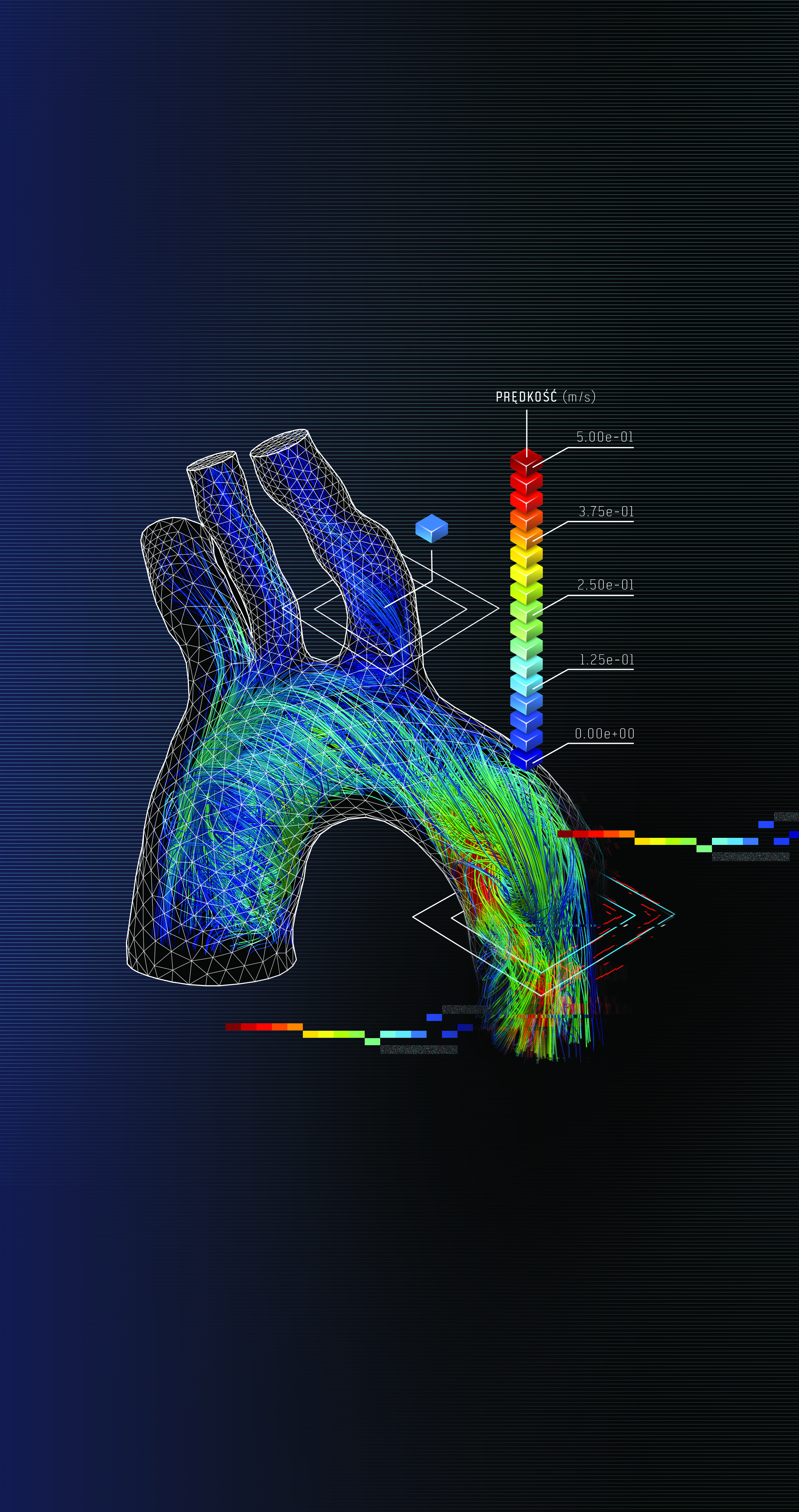
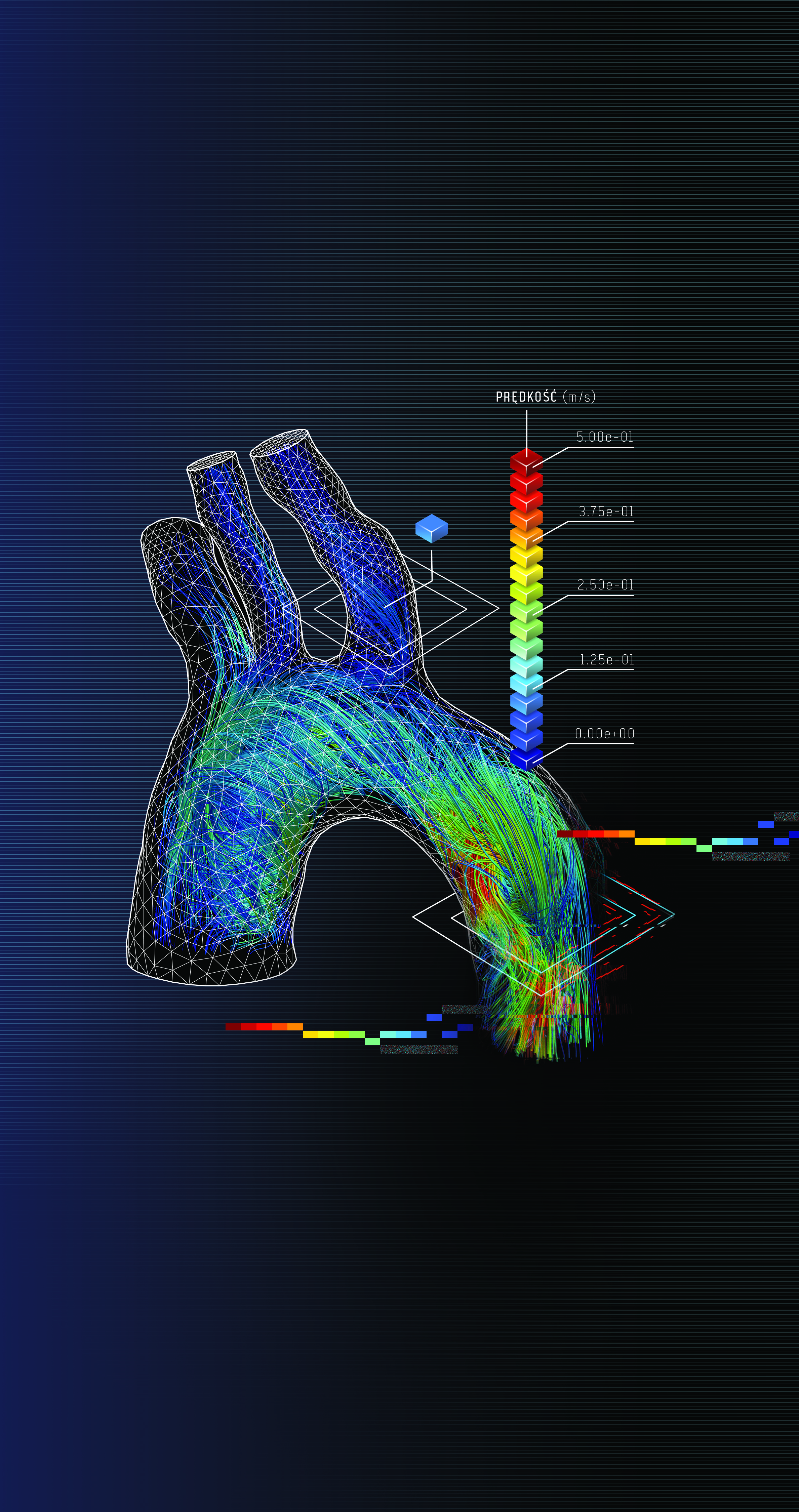
Od kilku lat na świecie prowadzone są badania odnośnie określania wirtualnej cząstkowej rezerwy przepływu (VFFR, CTFFR). Niektóre z nich bazują na informacji o różnicy średnicy światła naczynia, inne na numerycznych symulacjach przepływu. Nieinwazyjna ocena istotności blaszek miażdżycowych jest z pewnością jedną z największych zalet takiego podejścia. Bez konieczności wprowadzania sondy do tętnicy wieńcowej diagnosta otrzymuje możliwość sprawdzenia, w jakim stopniu zwężenie światła naczynia wpływa na wartości przepływu. Wirtualne symulacje umożliwiają jednak więcej niż wyznaczenie parametru FFR. Być może udzielą odpowiedzi na pytania często stawiane przez kardiologów interwencyjnych: gdzie i jak płynie krew oraz gdzie występują zaburzenia? Wizualizacja wyników w postaci barwnych linii przepływu (Rys. 2) znacznie ułatwia interpretację parametrów. Na ich podstawie diagnosta może prognozować lokalizacje powstawania nowych zmian miażdżycowych, a także ich charakter. Zwiększa to możliwości diagnostyki bazującej wyłącznie na obrazach medycznych.
Rys. 2 Wizualizacja przepływu krwi w aorcie uzyskana na podstawie symulacji numerycznej
Diagnostyka przyszłości?
Nowe technologie coraz szybciej wkraczają do medycyny. Kolejnym krokiem realizowanym przez Future Processing będzie potwierdzenie skuteczności zaproponowanej metody diagnostycznej. Być może zastosowanie uczenia maszynowego i algorytmów fizyki numerycznej pozwoli na szerszą i wcześniejszą diagnostykę miażdżycy, a w przyszłości także na przewidywanie zdarzeń sercowo-naczyniowych.