Inżynier i Fizyk Medyczny 4/2015 vol. 4
233
radioterapia
/
radiotherapy
artykuł naukowy
/
scientific paper
tylko do napromieniania zmian umiejscowionych w mózgu. Sto-
sując maski termoplastyczne, proces przygotowania chorego do
leczenia może być rozciągnięty w czasie, co ma istotne znaczenie,
biorąc pod uwagę procedury QA [13, 14]. Pamiętajmy, że radiochi-
rurgicznie leczone są także zmiany nowotworowe umiejscowio-
ne poza czaszką. W takim przypadku stosuje się również maski
termoplastyczne oraz materace podciśnieniowe (Fot. 4). Jest to
dobry, łatwy, wygodny dla pacjenta i precyzyjny sposób unieru-
chomienia chorego. Możliwe jest również wykorzystanie tego
systemu w czasie kilku frakcji, w czasie kilku dni leczenia. Obec-
nie coraz więcej firm proponuje różne systemy unieruchomienia,
wykorzystując doświadczenia frakcjonowanej radioterapii oraz
najnowsze technologie i materiały, np. włókno węglowe.
Systemy planowania leczenia
Komputerowe systemy planowania leczenia to dedykowane pro-
gramy komputerowe stosowane w radioterapii, przeznaczone
do wyliczania rozkładu dawki w ciele pacjenta. Zazwyczaj firmy
produkujące aparaty do napromieniania tworzą programy kom-
puterowe dedykowane dla konkretnych urządzeń, np. MultiPlan
dla CyberKnife, iPlan – dla BrainLab. Sposoby definiowania dawki
są przygotowane pod kątemmożliwości osiągnięcia określonego
celu terapeutycznego (np. wurządzeniu typu GammaKnife dawka
definiowana jest na wartości izodozy np. 50%). Różne sposoby de-
finiowania dawki mogą powodować trudności wocenie efektu te-
rapeutycznego oraz prowadzić do błędów dozymetrycznych [15].
Dodatkowo zdarza się, że rozkłady dawek zapisywane są w forma-
cie używanym tylko przez danego producenta, co uniemożliwia
ich eksport do systemów, które używają formatu DICOM RT [16].
Tym niemniej systemy planowania leczenia, dedykowane do ste-
reotaksji, podlegają ciągłej ewolucji, są coraz bardziej precyzyj-
ne, wykorzystują najnowsze rozwiązania w zakresie algorytmów
stosowanych do obliczania rozkładu dawek, uwzględniają coraz
więcej zjawisk fizycznych i są coraz bardziej precyzyjne wwykony-
wanych obliczeniach rozkładów dawek [17, 18, 19].
Porównanie dawki obliczonej
i dostarczonej
Radiochirurgia polega na podaniu w jednej lub kilku (stereotak-
sja) frakcjach promieniowania dużej dawki w bardzo małej obję-
tości, dlatego konieczne jest sprawdzenie, czy dawka wyliczona
w systemie planowania leczenia jest zgodna z dawką wygene-
rowaną przez aparat terapeutyczny. Niestety, dotychczas nie
dysponujemy dostępnymi komercyjnymi rozwiązaniami, któ-
re umożliwiają pomiar w czasie rzeczywistym rozkładu dawki
otrzymywanej przez pacjenta. Dozymetria
in-vivo
, którą wyko-
nuje się detektorami półprzewodnikowymi w technikach nie
dynamicznych, w radiochirurgii jest nieprzydatna ze względu na
wymiary wiązek oraz stosowanie technik dynamicznych [20]. Ru-
tynowym pomiarem, który należy wykonać przed zabiegiem te-
rapeutycznym, jest pomiar dawki i jej rozkładu bez pacjenta, wy-
korzystując matrycę detektorów. Może być ona częścią aparatu
terapeutycznego lub niezależnym urządzeniem pomiarowym
[21]. W jednym i drugim przypadku mierzymy mapę fluencji lub
rozkład dawki i porównujemy ją z obliczoną. W przypadku, gdy
matryca detektorów umieszczona jest w fantomie, wówczas
mierzymy i porównujemy rozkłady dawek. W tym celu stosuje się
tzw. współczynnik gamma [22], który równocześnie porównuje
w tym samym miejscu dawki zmierzone i obliczone oraz różnicę
pomiędzy położeniem samej dawki (Rys. 4).
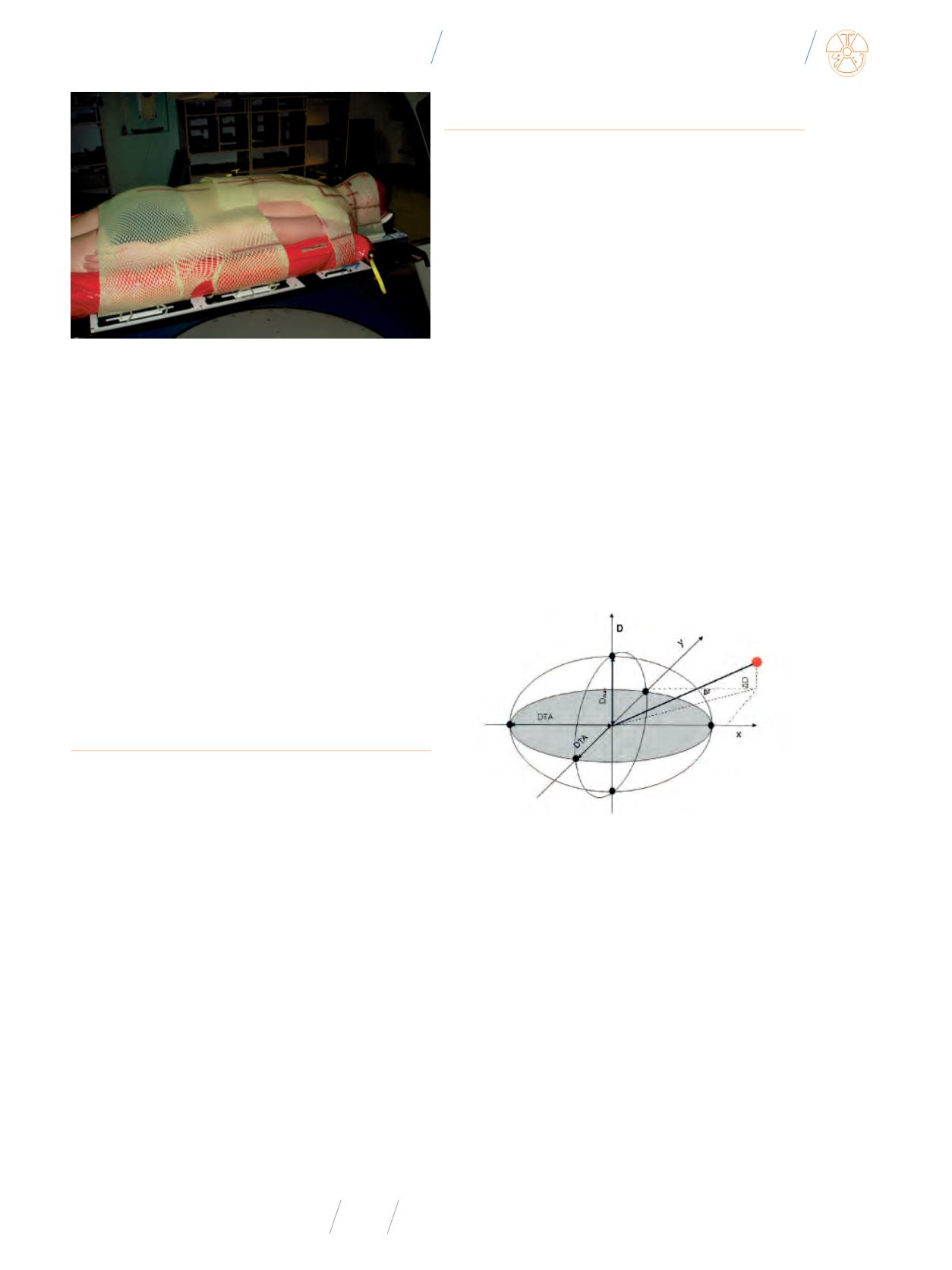
Rys. 4
Współczynnik gamma określa zgodność dawki zmierzonej i obliczonej oraz jej
położenie przestrzenne [23]. DTA – distance-to-agreement oraz D
max
– maksymalna
różnica pomiędzy dawką zmierzoną i obliczoną. Parametry te wyznaczają sferę. Je-
żeli wartość dawki zmierzonej znajduje się wewnątrz sfery, wówczas uznajemy, że
pomiar jest zgodny z obliczeniami.
Jeżeli wartość DTA zdefiniujemy jako 3 mm, a D
max
– 3%,
wówczas uznajemy, że pomiar jest zgodny z obliczeniami, kiedy
punkt pomiarowy zawarty jest w objętości o promieniach: DTA
i D
max
. Najczęściej przyjmujemy wartość 3% i 3 mm jako wartości
określające naszą akceptowalną różnicę pomiędzy pomiarem
i obliczeniami. Aby móc zmierzyć rozkład dawki, należy w sys-
temie planowania leczenia wygenerować plan weryfikacyjny,
który powstaje na bazie przygotowanego planu leczenia, tyle
tylko, że rozkład dawki wyliczony jest w fantomie pomiarowym
lub matrycy pomiarowej. W przypadku pomiaru map fluencji
mapy te generowane są również na podstawie przygotowane-
go planu leczenia. Innymi słowy, plan leczenia przygotowany dla
chorego jest przeliczany na warunki pomiaru
in-vitro
. Czy zatem
Fot. 4
Leczenie zmian nowotworowych pozaczaszkowych wymaga zastosowania
systemu unieruchamiania pacjenta. System ten składa się z maski termoplastycznej,
materaca podciśnieniowego oraz tacy z włókna węglowego, która mocowana jest
do stołu terapeutycznego. Sposób ten dobrze redukuje ruchomość chorego w czasie
seansu terapeutycznego.


